Page 24 - E-Modul Ikatan Kimia
P. 24
17 Unit 2 : Ikatan Ionik dan Ikatan Kovalen
Kovalen
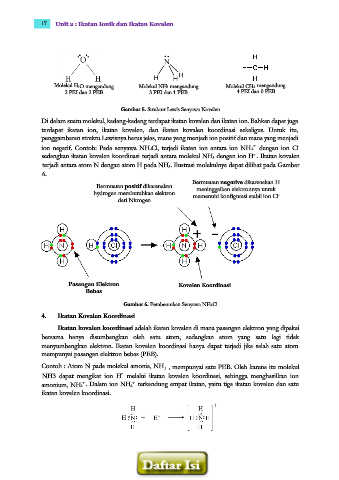
Molekul H2O mengandung Molekul NH3 mengandung Molekul CH4 mengandung
2 PEI dan 2 PEB 3 PEI dan 1 PEB 4 PEI dan 0 PEB
Gambar 5. Struktur Lewis Senyawa Kovalen
Di dalam suatu molekul, kadang-kadang terdapat ikatan kovalen dan ikatan ion. Bahkan dapat juga
terdapat ikatan ion, ikatan kovalen, dan ikatan kovalen koordinasi sekaligus. Untuk itu,
penggambaran struktu Lewisnya harus jelas, mana yang menjadi ion positif dan mana yang menjadi
+
ion negatif. Contoh: Pada senyawa NH4Cl, terjadi ikatan ion antara ion NH4 dengan ion Cl
-
sedangkan ikatan kovalen koordinasi terjadi antara molekul NH3 dengan ion H . Ikatan kovalen
+
terjadi antara atom N dengan atom H pada NH3. Ilustrasi molekulnya dapat dilihat pada Gambar
6.
Bermuatan negative dikarenakan H
Bermuatan positif dikarenakan meninggalkan elektronnya untuk
hydrogen membutuhkan elektron memenuhi konfigurasi stabil ion Cl
-
dari Nitrogen
Pasangan Elektron Kovalen Koordinasi
Bebas
Gambar 6. Pembentukan Senyawa NH4Cl
4. Ikatan Kovalen Koordinasi
Ikatan kovalen koordinasi adalah ikatan kovalen di mana pasangan elektron yang dipakai
bersama hanya disumbangkan oleh satu atom, sedangkan atom yang satu lagi tidak
menyumbangkan elektron. Ikatan kovalen koordinasi hanya dapat terjadi jika salah satu atom
mempunyai pasangan elektron bebas (PEB).
Contoh : Atom N pada molekul amonia, NH3 , mempunyai satu PEB. Oleh karena itu molekul
+
NH3 dapat mengikat ion H melalui ikatan kovalen koordinasi, sehingga menghasilkan ion
+
+
amonium, NH4 . Dalam ion NH4 terkandung empat ikatan, yaitu tiga ikatan kovalen dan satu
ikatan kovalen koordinasi.