Page 30 - E-Modul Ikatan Kimia
P. 30
23 Unit 2 : Ikatan Ionik dan Ikatan Kovalen
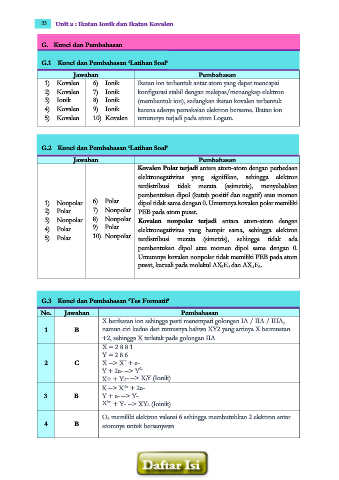
G. Kunci dan Pembahasan
G.1 Kunci dan Pembahasan ‘Latihan Soal’
Jawaban Pembahasan
1) Kovalen 6) Ionik Ikatan ion terbentuk antar atom yang dapat mencapai
2) Kovalen 7) Ionik konfigurasi stabil dengan melepas/menangkap elektron
3) Ionik 8) Ionik (membentuk ion), sedangkan ikatan kovalen terbentuk
4) Kovalen 9) Ionik karena adanya pemakaian elektron bersama. Ikatan ion
5) Kovalen 10) Kovalen umumnya terjadi pada atom Logam.
G.2 Kunci dan Pembahasan ‘Latihan Soal’
Jawaban Pembahasan
Kovalen Polar terjadi antara atom-atom dengan perbedaan
elektronegativitas yang signifikan, sehingga elektron
terdistribusi tidak merata (asimetris), menyebabkan
pembentukan dipol (kutub positif dan negatif) atau momen
1) Nonpolar 6) Polar dipol tidak sama dengan 0. Umumnya kovalen polar memiliki
2) Polar 7) Nonpolar PEB pada atom pusat.
3) Nonpolar 8) Nonpolar Kovalen nonpolar terjadi antara atom-atom dengan
4) Polar 9) Polar elektronegativitas yang hampir sama, sehingga elektron
5) Polar 10) Nonpolar terdistribusi merata (simetris), sehingga tidak ada
pembentukan dipol atau momen dipol sama dengan 0.
Umumnya kovalen nonpolar tidak memiliki PEB pada atom
pusat, kecuali pada molekul AX2E3 dan AX4E2.
G.3 Kunci dan Pembahasan ‘Tes Formatif’
No. Jawaban Pembahasan
X berikatan ion sehingga pasti menempati golongan IA / IIA / IIIA,
1 B namun ciri kedua dari rumusnya bahwa XY2 yang artinya X bermuatan
+2, sehingga X terletak pada golongan IIA
X = 2 8 8 1
Y = 2 8 6
+
2 C X --> X + e-
Y + 2e- --> Y
2-
X+ + Y2- --> X2Y (Ionik)
2+
X --> X + 2e-
3 B Y + e- --> Y-
2+
X + Y- --> XY2 (Ioinik)
O2 memiliki elektron valensi 6 sehingga membutuhkan 2 elektron antar
4 B atomnya untuk bersenyawa